Cuánto tarda en transformarse una sustancia
En esta secuencia didáctica se estudia la velocidad de las reacciones químicas en la conservación de alimentos. Para ampliar el tema con los estudiantes se proponen actividades de indagación científica referidas a este proceso.

La maduración de los frutos involucra reacciones químicas cuya velocidad varía según las condiciones climáticas.
(Foto cedida por la Secretaría de Turismo de la Nación de la República Argentina).
¿Por qué elegimos este tema?
En esta propuesta le prestaremos atención a la velocidad con que ocurren las reacciones químicas. Este tema es imprescindible para comprender aspectos del mundo que nos rodea; por ejemplo, que la lentitud con que ocurren las reacciones del oxígeno permite la presencia en nuestra atmósfera de los compuestos orgánicos que forman nuestros cuerpos. La comprensión de los factores que afectan la velocidad de una reacción permite, en algunos casos, controlarla. Así, los combustibles como el gas natural no reaccionan ante la presencia del oxígeno, pero el empleo de una chispa acelerará la reacción.
Permitiéndonos disponer de la energía que estas reacciones liberan, cuando y donde la necesitamos. El control de la velocidad también es importante en el diseño de productos farmacéuticos donde se requiere que una sustancia se libere a una determinada velocidad dentro del organismo.
Secuencia didáctica
La secuencia que le proponemos emplea los conceptos de mol, concentración y estequiometría y puede servir de introducción a un estudio más sistemático de los factores que afectan a las velocidades de reacción. En la propuesta también trabajaremos un modelo de indagación científica. Comenzaremos planteando un problema cotidiano y lo modelaremos con un sistema más sencillo. Luego formularemos una hipótesis del comportamiento de este sistema y la pondremos a prueba. Esto requerirá la planificación algunas experiencias y la selección de las técnicas adecuadas. Luego obtendremos algunas conclusiones de nuestras experiencias y las aplicaremos al sistema complejo. Finalmente formularemos estas conclusiones del modo más general posible a fin de que sean útiles para resolver otros problemas.
El problema que le sugerimos que trabaje es la conservación de jugo de naranja. Aquí el objetivo principal es retardar lo más posible las reacciones que degradan las sustancias que componen el jugo de naranja.
¿Qué sustancia de las que componen el jugo de naranja es la más importante de conservar? Este jugo contiene vitamina C (ácido ascórbico) que es un componente esencial de la dieta ya que el cuerpo es incapaz de elaborarla. Entonces, una solución de ascórbico será un modelo sencillo relevante para nuestro problema. Una tableta de vitamina C comercial contiene 2 gramos de ácido ascórbico. Un litro de jugo de naranja contiene aproximadamente 700 miligramos.
Una vez que haya planteado este problema al estudiantado puede trabajar con ellas y ellos en la elaboración de hipótesis alrededor de los factores que influyen en la degradación de esta sustancia partiendo de sus conocimientos. Dos posibles candidatos son el calor ―que muchas conduce a la descomposición de los alimentos― y el aire ―porque el jugo de naranja se comercializa cerrado―.
Para investigar estas hipótesis puede almacenar soluciones de ascórbico en distintas condiciones y medir cómo varía su concentración a tiempos diferentes. Para este propósito es necesaria un técnica que permita medir la concentración del ácido ascórbico. Una alternativa es emplear la reacción del ácido ascórbico con el yodo:
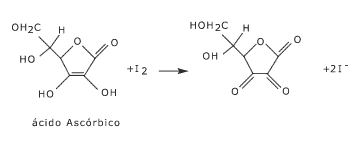
Esta técnica se basa en que, como el yodo es coloreado y el ioduro es transparente, el agregado de una solución de ácido ascórbico solo decolorará la solución de yodo cuando la cantidad incorporada sea suficiente para transformar todo el yodo presente al inicio. El agregado gota a gota de solución de ácido ascórbico permitirá hallar el mínimo volumen necesario para que produzca la decoloración del yodo. En ese momento habremos agregado la misma cantidad de moles de ácido ascórbico que los moles de yodo presentes en la solución (ver ecuación). A medida que se descomponga el ácido ascórbico en la solución expuesta a diferentes condiciones, la concentración de esta sustancia será menor y se necesitarán volúmenes mayores de solución para decolorar la misma cantidad de solución de yodo. Si no es posible decolorar el yodo por más solución que se agregue, esto indicará que el ácido ascórbico inicial se ha descompuesto totalmente.
Esta técnica se denomina iodometría. Cuando disponemos de soluciones de yodo de concentración conocida ella nos permite cuantificar el ácido ascórbico u otras sustancias oxidables por el yodo.
Ahora puede planear con sus estudiantes los ensayos por realizar. Pueden almacenar porciones idénticas (por ejemplo, 250 ml) de una solución de ácido ascórbico de similar concentración que la presente en el jugo de naranja en distintas condiciones tales como cerrada en la heladera, abierta en la heladera, abierta a temperatura ambiente y cerrada a temperatura ambiente. Luego podrán determinar, a intervalos regulares de tiempo, el volumen de cada solución almacenada en distintas condiciones que se precisa para decolorar una cantidad fija de solución de yodo.
Esta información le permitirá evaluar con sus estudiantes cuáles son las mejores condiciones para almacenar una solución de ácido ascórbico y discutir la importancia de este resultado para decidir cómo conservar un jugo de naranja. Para comprobar la eficacia del modelo puede realizar un estudio similar, pero usando jugo de naranja (natural o comercial). En este caso, las y los estudiantes pueden planear sus experiencias en forma más autónoma y reflejar sus hallazgos en distintos formatos como, por ejemplo, realizando exposiciones ante el resto de la clase o presentando informes escritos. La comparación de los resultados en ambas clases de jugos puede revelar la presencia de conservantes en el jugo comercial.
A partir de las conclusiones obtenidas, podrás proponer un proceso que conduce a la degradación del ácido ascórbico. La reacción que consume al ácido ascórbico es su oxidación por el oxígeno (similar a la reacción del ácido ascórbico con el yodo). Al almacenar las soluciones en frascos cerrados se limita el contacto de la solución con el aire y, por lo tanto, disminuye la concentración de uno de los reactivos de la reacción (el oxígeno). La temperatura es otro de los factores que afectan la velocidad de esta reacción. El comportamiento observado es compatible con lo que sabemos acerca del comportamiento de las reacciones químicas. La velocidad de reacción depende de las concentraciones de los reactivos y de la temperatura.
Sugerencias para seguir trabajando
Es interesante extender el alcance de este estudio analizando estrategias de conservación para otros alimentos y discutiendo temas tales como la importancia de mantener la cadena de frío, las distintas formas de envasado o la adición de antioxidantes, conservantes, etcétera.
Recomendados
Proteínas: nutrientes y moléculas
Interactivo
Esta secuencia relaciona aspectos químicos y biológicos para explicar qué son las proteínas y qué funciones cumplen a nivel nutricional. También describe su estructura química y sus propiedades.
Ciencia a lo bestia: la degradación del agua
Video
¿Por qué el agua embotellada tiene fecha de vencimiento? En este micro, incluido en el capítulo 10 de la primera temporada de Proyecto G, Diego Golombek nos responde esta pregunta y nos habla de la degradación de ciertas sustancias.
Serie electroquímica
Texto
Esta secuencia didáctica presenta actividades cuyo objetivo es el estudio de relaciones rédox entre metales midiendo variables eléctricas.
Ficha
Publicado: 09 de agosto de 2007
Última modificación: 03 de enero de 2022
Audiencia
Docentes
Área / disciplina
Química
Ciencias Naturales
Nivel
Secundario
Categoría
Actividades
Modalidad
Todas
Formato
Texto
Etiquetas
mol
conservación de alimentos
velocidad de las reacciones químicas
estequiometría
reacción química
Autor/es
Educ.ar
Licencia
Creative Commons: Atribución – No Comercial – Compartir Igual (by-nc-sa)
