Solubilidad de gases
 |
Autores: Silvia Cerdeira, Helena Ceretti y
Eduardo Reciulschi. Responsable disciplinar:
Silvia Blaustein. Área disciplinar:
Química. Temática: Estados de la materia,
soluciones. Nivel: Secundario, ciclo
básico. Secuencia didáctica elaborada por Educ.ar.
|
|---|
Propósitos generales
• Promover el uso de los equipos portátiles en el proceso de enseñanza y aprendizaje.• Promover el trabajo en red y colaborativo, la discusión y el intercambio entre pares, la realización en conjunto de la propuesta, la autonomía de los alumnos y el rol del docente como orientador y facilitador del trabajo.
• Estimular la búsqueda y selección crítica de información proveniente de diferentes soportes, la evaluación y validación, el procesamiento, la jerarquización, la crítica y la interpretación.
Introducción a las actividades
¿Por qué una gaseosa pierde más rápido el gas cuando está caliente que cuando está fría? ¿Por qué el chocolate en polvo se disuelve mejor en leche caliente? Este tipo de comportamiento puede entenderse más fácilmente cuando se estudia el efecto de la temperatura sobre la solubilidad de las sustancias.
Por lo general, la solubilidad varía con la temperatura. En la mayoría de las sustancias, un incremento de la temperatura causa un aumento de la solubilidad. Por eso el azúcar se disuelve mejor en café caliente, y la barra de chocolate debe sumergirse en leche caliente para hacer un submarino.
En general, los cambios de presión no modifican sustancialmente la solubilidad de un sólido en un líquido. Si un sólido es insoluble en agua, no se disolverá aunque se aumente bruscamente la presión ejercida sobre él.
La solubilidad de los gases en líquidos presenta un comportamiento diferente de la que poseen los sólidos. Tanto la presión como la temperatura tienen una fuerte influencia sobre su solubilidad.
¿Qué es lo que está pasando con las moléculas? Al aumentar la temperatura, se incrementa la energía de movimiento (cinética) de las partículas de soluto y solvente, con lo que las fuerzas intermoleculares se debilitan. De esta forma, se establecen interacciones entre sus partículas y las de solvente, favoreciendo la mezcla.
En el caso de los gases, la disminución de fuerzas intermoleculares «libera» a las moléculas de gas de las fuerzas que las mantienen en solución y escaparán del recipiente, con lo que se observará que al aumentar la temperatura, disminuye la solubilidad de un gas en un solvente como el agua.
Los gases disueltos en agua potable (fundamentalmente oxígeno y nitrógeno, los componentes principales del aire) son responsables de las pequeñas burbujas que aparecen cuando el líquido se calienta y aún no llega al punto de ebullición. Es decir, a medida que se va calentando, las moléculas van adquiriendo la energía cinética suficiente como para ir abandonando el líquido. Cuando el agua hierve, queda totalmente desgasificada y se requiere un tiempo para que estos gases vuelvan a incorporarse al líquido.
Esta sería una buena explicación de por qué mucha gente dice que el gusto del mate es diferente si el agua se hirvió y se dejó enfriar. No porque los gases tengan sabor, sino porque las interacciones con las moléculas de la yerba ahora serán diferentes por no haber gases disueltos en el agua.
Objetivos de las actividades
Que los alumnos:
• estudien la dependencia de la solubilidad de los gases en líquidos con la temperatura y la presión;• vinculen el estudio de estos fenómenos con la problemática ambiental asociada a la actividad industrial y el cambio climático.
Actividad 1
La solubilidad de un gas en agua aumenta con la presión ejercida por el gas sobre el disolvente. Si la presión disminuye, la solubilidad disminuye también. Se dice que la solubilidad de los gases es directamente proporcional a la presión.
A nivel molecular, la solubilidad de un gas podría explicarse mediante las interacciones dipolo o dipolo inducido (dependiendo del tipo de gas) con las moléculas del solvente.
Tanto para la fabricación de soda como para la de bebidas gaseosas, se emplea dióxido de carbono (CO2) a presión para obtener las burbujas características.
Según la Ley de Henry, la solubilidad de un gas en un líquido es proporcional a la presión del gas sobre el líquido. Si se denomina Sg a la concentración molar del gas disuelto en el líquido y P a su presión, entonces:
Sg = kH . Pg kH = constante de HenryCuando se destapa una botella de gaseosa, la presión sobre la superficie del líquido se reduce y cierta cantidad de burbujas de dióxido de carbono suben a la superficie. La disminución de la presión permite que el dióxido de carbono salga de la disolución.
Vean el video «Ley
de Henry: solubilidad en gases líquidos»
Empleando el programa Draw de sus equipos portátiles, realicen una secuencia en la que pueda visualizarse cómo se comportan las moléculas de gas dentro de un líquido cuando aumenta la presión. Pueden ayudarme mirando el video «Henry's Law». Si bien está en inglés, las imágenes pueden aportarles buenas ideas.
Actividad 2
En relación con la temperatura, los gases disueltos en líquidos se comportan de forma inversa a como lo hacen los sólidos. La solubilidad de un gas en agua decrece a medida que aumenta la temperatura; esto significa que la solubilidad y la temperatura son inversamente proporcionales.
La solubilidad de un gas también disminuye con la presencia de un sólido. Las interacciones entre las partículas de un soluto sólido y las de un solvente son mucho más fuertes que entre las partículas de un gas y el solvente, por lo que al disminuir las interacciones entre el solvente y el gas, las moléculas gaseosas tendrán mayor tendencia a escapar de la solución.
Comprueben experimentalmente la variación de la solubilidad del dióxido de carbono en una gaseosa cuando cambia la temperatura. También verificarán que el gas se libera más rápidamente si se agrega un soluto sólido.
Para ello emplearán un sistema de cuba neumática. La cuba neumática es un invento del siglo XVIII realizado por Stephen Hales y que Prestley, Lavoisier y Dalton emplearon en muchos de sus experimentos.
Una cuba neumática es, básicamente, un dispositivo que consta de un tubo invertido sumergido en un recipiente con líquido. Si se hace burbujear un gas dentro del tubo invertido, este desplazará al líquido del tubo y se podrá medir su volumen.
Esta actividad requiere realizar varias operaciones simultáneamente, por lo que es necesario trabajar en grupos de tres o cuatro alumnos.
Materiales
• Cubeta o recipiente de plástico tipo pote de helado grande o ensaladera.• Agua.
• Botella plástica de gaseosa de 1 l, vacía.
• Manguera plástica delgada de 45 cm.
• Plastilina.
• 3 gaseosas pequeñas en botella (una fría, otra natural y otra en un baño María a 45 ºC o que haya estado un rato largo al sol).
• Un termómetro.
• 3 sobres de azúcar.
• Un marcador de tinta indeleble.
• Una probeta o recipiente para medir volúmenes.
Procedimiento
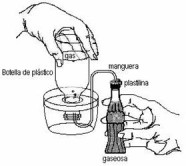
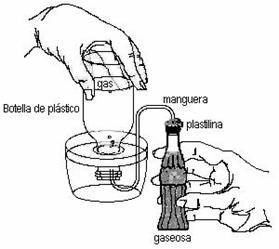
1. Llenen la botella plásticade un litro y la cubeta con agua. Coloquen la botella invertida en la cubeta como indica la figura.
2. Coloquen plastilina exteriormente en uno de los extremos de la manguera (si se puede, introduzcan también una tapa de gaseosa perforada junto con la plastilina, para evitar pérdidas). Tapen con el dedo el extremo al que le colocaron la plastilina.
3. Introduzcan el extremo libre de la manguera dentro de la botella invertida.
4. Destapen la gaseosa y tomen la temperatura con un termómetro.
5. Agreguen a la gaseosa el contenido de un sobre de azúcar e inmediatamente coloquen el extremo de la manguera con la plastilina (y la tapa perforada, si se puede) como se muestra en la figura.
6. Observen el desprendimiento de gas y su acumulación en la botella invertida.
7. Cuando la producción de gas se haya detenido, indiquen con el marcador en el punto que delimita el volumen de gas recogido.
8. Retiren la botella de la cubeta y llénenla con agua hasta la marca. Midan el volumen de agua que hay hasta la marca con la probeta (que será igual al volumen de gas generado).
a) Repitan el experimento pero empleando las otras dos gaseosas.
b) Con los datos de temperatura de la gaseosa y el volumen de dióxido de carbono obtenido, armen una tabla en Calc y realicen un grafiquen solubilidad en función de la temperatura.
c) Observando el gráfico respondan: ¿cómo es la relación entre las variables?
Actividad 3
El oxígeno, al igual que la mayoría de los gases, puede disolverse en los líquidos aunque en muy baja proporción, aproximadamente 3 a 5 mg/l o ppm a una dada temperatura.
El oxígeno gaseoso disuelto en el agua de ríos, lagunas, etc., es vital para la existencia de la mayor parte de los organismos acuáticos aeróbicos. El oxígeno es un componente clave en la respiración celular, tanto para la vida acuática como para la terrestre. La concentración de oxígeno disuelto (OD) en un ambiente acuático es un indicador importante de la calidad del agua.
Algunos organismos, como el salmón y la trucha, requieren grandes cantidades de oxígeno disuelto. Otros organismos, como las larvas de mosquito y la carpa, pueden sobrevivir en ambientes con menores concentraciones de oxígeno disuelto.
Grandes fluctuaciones en los niveles de oxígeno alteran la supervivencia de las diferentes especies acuáticas y provocan bruscos cambios en el ecosistema.
Como vieron, la temperatura es un factor de suma importancia en cuanto a la solubilidad del oxígeno. Las empresas que emplean fuentes naturales de agua como sistema de enfriamiento de sus procesos vuelcan a los ríos agua a mayor temperatura que la ambiente. Por otra parte, la generación de grandes cantidades de dióxido de carbono producidas por las sociedades modernas a través de la quema de combustibles fósiles, causa un aumento de la temperatura global. Ambos fenómenos pueden alterar el delicado balance del oxígeno en el agua.
a) Busquen información sobre las consecuencias de la disminución de oxígeno en las aguas naturales en los periódicos locales o en organizaciones gubernamentales y no gubernamentales (ONG) de su zona. Si disponen de conexión a Internet, realicen una búsqueda también por este medio.
Como ejemplo, pueden consultar:
El cambio climático amenaza supervivencia de peces
«Peces
en peligro por el calentamiento global», Diario
de Cuyo
Con la información recolectada, y utilizando el programa MovieMaker un video de no más de 3 minutos referido al estado de esta problemática dirigido a la comunidad local.