Entropía
 |
Autor: Hernán Ferrari Responsable
disciplinar: Silvia Blaustein Área
disciplinar: Física Temática: La
entropía y el segundo principio de la termodinámica Nivel:
Secundario, ciclo básico Secuencia didáctica
elaborada por Educ.ar |
|---|
Propósitos generales
Promover el uso de los equipos portátiles en el proceso de enseñanza y aprendizaje.
Promover el trabajo en red y colaborativo, la discusión y el intercambio entre pares, la realización en conjunto de la propuesta, la autonomía de los alumnos y el rol del docente como orientador y facilitador del trabajo.
Estimular la búsqueda y selección crítica de información proveniente de diferentes soportes, la evaluación y validación, el procesamiento, la jerarquización, la crítica y la interpretación.
Introducción a las actividades
El estudio de la entropía de un proceso permite predecir en qué sentido se desarrolla este cuando lo hace de manera espontánea. Además, explica por qué en la naturaleza un suceso ocurre de una manera y no de otra. Por ejemplo, si lanzamos un vaso de vidrio al suelo, se romperá y se esparcirá en múltiples pedazos. Sin embargo, si se tiran los pedazos del vaso al piso, jamás sucederá que el vaso se rearme por sí solo.
La entropía puede interpretarse como una medida de la distribución aleatoria de un sistema. Se dice que en un sistema altamente desordenado, este valor es alto. La entropía alcanzará un máximo cuando el sistema se acerque al equilibrio y, entonces, se alcanzará la configuración de mayor probabilidad. Esta magnitud puede considerarse también como la medida del desorden de un sistema, es decir, su grado de homogeneidad.
La variación de entropía muestra la variación del orden molecular ocurrido en una reacción química. Si el incremento de entropía es positivo, los productos presentan un mayor desorden molecular (mayor entropía) que los reactivos. En cambio, cuando el incremento es negativo, los productos son más ordenados. Hay una relación entre la entropía y la espontaneidad de una reacción química, que viene dada por la energía libre.
Objetivo de las actividades
Que los alumnos analicen el concepto de entropía, cómo esta magnitud determina el sentido de una transformación y cuál es su relación con el desorden de un sistema.
Actividad 1
1. Observen el siguiente video sobre la entropía y luego resuelvan el cuestionario:
- a) ¿Cómo se simula la interacción entre cuerpos a distintas temperaturas en un cálculo de dinámica molecular? Obtengan imágenes del video y expliquen a qué corresponden los círculos verdes y las flechas que se ven dentro de ellos.
- b) ¿Qué sucede con la energía térmica y cuál es el estado final de equilibrio?
- c) ¿Qué sucede con un cuerpo que cae cuando rebota contra el suelo? ¿Cómo se explica esto desde el punto de vista molecular? ¿En qué se convierte la energía potencial y cinética del cuerpo a medida que sus rebotes son cada vez menores?
- d) ¿Están quietos los átomos que conforman un cuerpo?
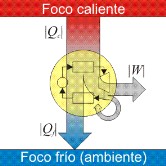
- e) Describan la máquina ideal de Carnot y cómo es su funcionamiento.
- f) ¿A qué área de la física dio origen el trabajo de Carnot y quiénes continuaron su trabajo?
- g) ¿Qué magnitud se mantiene constante en un ciclo de Carnot? ¿Cuál es su nombre y expresión?
- h) ¿Qué dos magnitudes se conservan en una máquina ideal a lo largo de un ciclo?
- i) ¿Qué sucede en una máquina real? ¿Qué sucede con la energía, el trabajo y la entropía comparada con la de una máquina ideal?
- j) ¿Cómo es la entropía total luego de un ciclo en una máquina real?
- k) ¿Qué sucede con las máquinas de la naturaleza y la entropía?
- l) ¿Cuándo aumenta y cuándo disminuye la entropía de un cuerpo?
- m) ¿Qué sucede con la entropía al poner en contacto un cuerpo caliente con uno frío? ¿Hasta cuándo sucederá esto?
- n) ¿Cuál es el estado de máxima entropía de un cuerpo?
2. Realicen un informe con el programa Write de sus equipos portátiles que incluya las distintas respuestas de la actividad y las conclusiones a las que hayan podido arribar.
Actividad 2
1. Observen este segundo video sobre la entropía para resuelver el siguiente cuestionario:
- a) ¿Por qué el hielo se mantiene a cero grados en una mezcla de hielo y agua? Desde el punto de vista de la entropía, ¿por qué el hielo se convierte en agua y no es al revés? ¿Cuál de los dos estados, el líquido o el sólido, es más caótico?
- b) ¿Cómo se puede interpretar el aumento de la entropía en función del orden o desorden?
- c) ¿Cómo es la energía potencial y la entropía en un líquido respecto de un sólido?
- d) Cuando el hielo se funde, aumentan su entropía y energía; esto ocurre debido a que el hielo absorbe calor de su entorno. Como la cantidad de energía se conserva, la temperatura del agua que rodea al hielo disminuye, ya que la misma entregó una cantidad de energía equivalente a la que absorbió este último... ¿Qué sucede con la entropía del agua que rodea al hielo? ¿Cómo es esta variación de entropía comparada con el aumento de la entropía del cubo de hielo fundiéndose?
- e) ¿Cómo se define la energía libre? ¿Cómo se puede interpretar su significado?
- f) ¿El aumento de entropía del universo lleva al orden o al desorden? ¿Cómo se llama a este final del universo?
- g) Expliquen cómo el aumento de la energía puede definir la dirección del flujo del tiempo.
2. Realicen un informe con el programa Write de sus equipos portátiles que incluya las distintas respuestas de la actividad y las conclusiones a las que hayan podido arribar.