Las bajas temperaturas (I)
 |
Autor: Hernán Ferrari Responsable
disciplinar: Silvia Blaustein Área
disciplinar: Física Temática: Fases
de la materia en función de la temperatura y la presión Nivel:
Secundario, ciclo básico Secuencia didáctica
elaborada por Educ.ar |
|---|
Propósitos generales
Promover el uso de los equipos portátiles en el proceso de enseñanza y aprendizaje.
Promover el trabajo en red y colaborativo, la discusión y el intercambio entre pares, la realización en conjunto de la propuesta, la autonomía de los alumnos y el rol del docente como orientador y facilitador del trabajo.
Estimular la búsqueda y selección crítica de información proveniente de diferentes soportes, la evaluación y validación, el procesamiento, la jerarquización, la crítica y la interpretación.
Introducción a las actividades
Normalmente, a las bajas temperaturas se las llama temperaturas criogénicas. Por lo general, son las que se encuentran por debajo de la temperatura de ebullición del aire líquido (cerca de 190 grados centígrados por debajo del cero). De acuerdo con las recomendaciones aprobadas por la XIII Conferencia del Instituto Internacional del Frío (1971), debe denominarse así a las temperaturas inferiores a los -150 ºC.
Para alcanzar y mantener bajas temperaturas, por lo general se utilizan gases licuados (agentes frigoríficos). En un vaso de Dewar con gas licuado que se evapora a la presión atmosférica, la temperatura de ebullición constante del agente refrigerante se mantiene bastante bien. En la práctica se utilizan los siguientes agentes refrigerantes: aire (temperatura de ebullición –TE- de aproximadamente 80 K), nitrógeno (cuya TE es igual a 77,4 K), neón (TE, 27,1 K), hidrógeno (TE, 20,4 K) y helio (TE, 4,2 K).
Objetivo de las actividades
Que los alumnos estudien el comportamiento de la materia en función de la temperatura y la presión a la que se encuentra.
Actividad 1
1. Observen el siguiente video sobre las bajas temperaturas para resolver el cuestionario que aparece a continuación.
- Cuestionario:
- a) ¿Qué tarea se realiza en la planta industrial? (Se observa al comienzo del video.)
- b) ¿Cuál es el gas utilizado como materia prima en esta planta? ¿Qué sucede con la temperatura de un gas al comprimirlo? ¿Qué sucede entonces al expandirse el gas?
- c) En la expansión, el gas se enfría y puede absorber calor de otra tubería con gas caliente y así, ir enfriándolo. ¿Cuántas veces se realiza este proceso en la planta?
- d) ¿Cuáles son los elementos que constituyen más del 95% del aire?
- e) ¿A qué temperatura se licúa el oxígeno? ¿De qué color es el oxígeno líquido?
- f) ¿Qué sucede con la humedad del aire que rodea los caños a bajas temperaturas de la planta, aunque estén bajo el sol del mediodía?
- g) ¿De qué variables depende que la materia sea sólida, líquida o gaseosa?
- h) ¿Cuál fue el primer gas licuado por el hombre en un experimento realizado por Faraday?
- i) Descubran los estados sólidos, líquidos y gaseosos en función de la temperatura de una sustancia. Obtengan fotos del video con la organización de los átomos de la sustancia para cada caso.
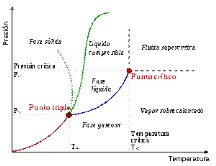
- j) Obtengan una imagen del diagrama de fases de una sustancia (fase sólida, líquida o gaseosa) en función de la presión y la temperatura. Indiquen en la imagen qué región corresponde a cada fase. ¿Qué sucede con la línea que separa el líquido del gas y cómo se comporta la sustancia por arriba del punto crítico?
- k) Describan el experimento con etano líquido para mostrar la existencia del punto crítico. Obtengan imágenes de las distintas etapas del experimento mostrando los estados del etano. En determinado momento del experimento, el etano se vuelve opaco y la luz no puede pasar a través de él, ¿por qué ocurre esto?
2. Realicen un informe con el programa Write de sus equipos portátiles que incluya las distintas respuestas de la actividad y las conclusiones a las que hayan podido arribar.
Actividad 2
1. Observen la segunda parte del video sobre bajas temperaturas y luego resuelvan el cuestionario:
- Cuestionario:
- a) ¿Cómo es posible que el oxígeno en estado líquido, enfriado a -183 ºC, esté en ebullición?
- b) ¿Qué sucede con las moléculas de un líquido al aumentar su temperatura por arriba de la temperatura de ebullición? ¿Qué sucede con la velocidad de las partículas? ¿Qué sucede con las moléculas que logran escapar del líquido y así evaporarse? ¿Qué pasa con la temperatura del líquido? Expliquen cuál es la función de la transpiración en el ser humano en un día de calor.
- c) ¿Cómo es la temperatura del punto crítico del dióxido de carbono? ¿En qué estado se lo encuentra a temperatura ambiente y presión atmosférica de 1 atm?
- d) El profesor del video tiene un tubo de dióxido de carbono a una presión aproximada de 73 veces la presión atmosférica. ¿A qué temperatura y en qué estado está el dióxido de carbono dentro del tubo a alta presión? Cuando abre el tubo, ¿qué sucede con la temperatura del gas que sale hasta que llega a la presión atmosférica?
- e) En un baño de hielo seco y éter frío y comprimido a 40 atmósferas, Faraday logró licuar todos los gases que eran conocidos en esa épocaexcepto tres. ¿Cuáles fueron?
- f) ¿Cómo funciona un intercambiador de calor, dispositivo que permite enfriar un gas caliente utilizando otro gas frío proveniente, por ejemplo, de una expansión?
- g) ¿Cuál fue la equivalencia entre energía mecánica y calor encontrada por Joule?
- h) ¿Cuál es el efecto descubierto por Joule y Thomson al estudiar la conservación de la energía y que lleva sus nombres? Describan el efecto en detalle utilizando capturas de pantalla para mostrar imágenes en el informe final.
- i) ¿Cuál es la última etapa en la licuefacción de un gas?
2. Realicen un informe con el programa Write de sus equipos portátiles que incluya las distintas respuestas de la actividad y las conclusiones a las que hayan podido arribar.