Uniones covalentes (III). Polaridad de enlaces y moléculas
 |
Autores: Silvia Cerdeira, Helena Ceretti y
Eduardo Reciulschi. Responsable disciplinar:
Silvia Blaustein. Área disciplinar:
Química. Temática: Tipo de uniones
químicas. Geometría molecular y polaridad. Nivel:
Secundario, ciclo básico. Secuencia didáctica
elaborada por Educ.ar. |
|---|
Propósitos generales
• Promover el uso de los equipos portátiles en el proceso de enseñanza y aprendizaje.• Promover el trabajo en red y colaborativo, la discusión y el intercambio entre pares, la realización en conjunto de la propuesta, la autonomía de los alumnos y el rol del docente como orientador y facilitador del trabajo.
• Estimular la búsqueda y selección crítica de información proveniente de diferentes soportes, la evaluación y validación, el procesamiento, la jerarquización, la crítica y la interpretación
Introducción a las actividades
La electronegatividad es una propiedad química que mide la capacidad que tiene un átomo de atraer electrones en una unión covalente. Aquellos elementos que tengan una mayor capacidad para atraer electrones serán los más electronegativos.
El elemento más electronegativo de la tabla periódica es el flúor. Este elemento tiene un radio atómico pequeño y, ganando un electrón, completa su nivel energético alcanzando una configuración electrónica estable. Los valores de electronegatividad fueron dados por Linus Pauling y varían desde 0,7 para el cesio hasta 4,0 para el flúor.
En la tabla periódica, la electronegatividad aumenta hacia arriba en un grupo, y de izquierda a derecha en un período. En general, los metales tienen baja electronegatividad (tienden a ceder sus electrones para formar cationes) mientras que los no metales presentan valores de electronegatividad más elevados.
Objetivos de las actividades
Que los alumnos:
• reconozcan uniones covalentes polares;• estimen la polaridad de las moléculas;
• relacionen la polaridad de una molécula con una propiedad medida experimentalmente.
Actividad 1. Electronegatividad y polaridad de las uniones
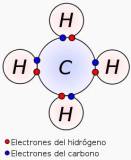
Cuando un átomo de cloro se une a uno de potasio, se produce una transferencia de electrones del metal al no metal, que forma un compuesto iónico. Si el átomo de cloro se une a otro átomo de cloro, al ser dos no metales comparten un par de electrones que se encuentran, en promedio, en la zona intermedia entre los dos átomos. La nube de electrones que los rodea es simétrica y la molécula se llama molécula no polar.
Pero si un átomo de cloro se une a un átomo de hidrógeno, el par de electrones compartido entre ellos es cercano al átomo más electronegativo (dado que este tiene mayor capacidad de atraer a los electrones). La nube de electrones entre ambos átomos no es simétrica, sino que se encuentra desplazada hacia el cloro. Entonces, queda una fracción de carga negativa sobre el cloro y una fracción de carga positiva sobre el hidrógeno. Como se separan dos polos, la molécula se denomina polar o dipolar. Cuanto mayor sea la diferencia de electronegatividad entre los elementos que forman la unión, mayor será la polaridad de ella.

Estrictamente, la unión covalente será no polar cuando esté formada por dos átomos de igual electronegatividad. Si los átomos que están unidos son diferentes, existirá toda una gama de polaridades que será mayor al aumentar la diferencia de electronegatividades. En general, se considerará aquí que un compuesto iónico está formado por un metal y un no metal, mientras que será covalente (con diferentes grados de polaridad) si está formado por no metales (luego se considerarán algunas excepciones, cuando se traten ácidos y bases en solución acuosa).
Se tienen las siguientes sustancias:
• Flúor, F2• Fluoruro de potasio, KF.
• Fluoruro de hidrógeno, HF
• Bromuro de sodio, NaBr
• Hidrógeno, H2
• Bromuro de hidrógeno, HBr
a) Evalúen si son compuestos iónicos o covalentes. Si son covalentes, piensen si son moléculas polares o no polares. Utilicen los valores de electronegatividad de la tabla periódica interactiva o búsquenlos en esta tabla periódica.
También pueden mirar la simulación de polaridad Naturaleza del enlace químico.
b) Pueden usar el programa Paint o Draw para dibujar todas las
moléculas indicando el dipolo en aquellas que son polares.
Actividad 2. Geometría y polaridad de las moléculas
En el caso de moléculas poliatómicas, para evaluar si son polares o no, deben seguir estos pasos:
1. Hagan el diagrama de Lewis de la molécula.
2. Determinen la geometría molecular.
3. Busquen la electronegatividad de cada elemento y determinen si las uniones individuales que forman la molécula son polares.
4. Determinen la dirección del vector en cada una de las uniones polares (este se dirigirá hacia el elemento más electronegativo).
5. Evalúen si todos los dipolos de las uniones son iguales o diferentes (es decir, si la diferencia de electronegatividad entre los diferentes elementos es igual, mayor o menor para todas las uniones).
6. Estimen si la suma vectorial de todos los dipolos (en realidad, debería hablarse de momentos dipolares) entre cada uno de los átomos presentes y el átomo central será igual a cero (molécula no polar) o distinta de cero (molécula polar).
Nota: en realidad no se realiza una suma exacta de vectores sino que se estiman sus magnitudes.
Mediante la determinación gráfica del momento dipolar total (µ total), se puede predecir si las moléculas son o no polares. Esta característica determinará sus propiedades, como su solubilidad en agua.
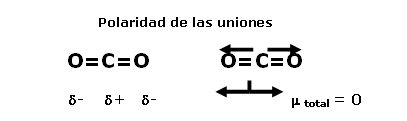
En el caso del dióxido de carbono, por ejemplo, existen dos densidades electrónicas negativas alrededor del átomo central. La manera de disminuir la repulsión entre ellas es ubicarlas a 180º, es decir, la molécula es lineal.
Molécula lineal
O=C=O
La electronegatividad del oxígeno es 3,5, y la del carbono, 2,5, por lo tanto, la diferencia entre ellas es de 1, y ambas uniones son polares. El polo negativo del dipolo se orienta hacia el oxígeno. Los vectores son de igual magnitud y sentido contrario. Como la molécula es lineal, la suma vectorial es cero y la molécula es no polar.
Determinen si las siguientes moléculas son polares o no:
• Agua, H2O.• Disulfuro de carbono, CS2.
• Metano, CH4.
• Amoníaco, NH3
• Trifluoruro de boro, BF3.
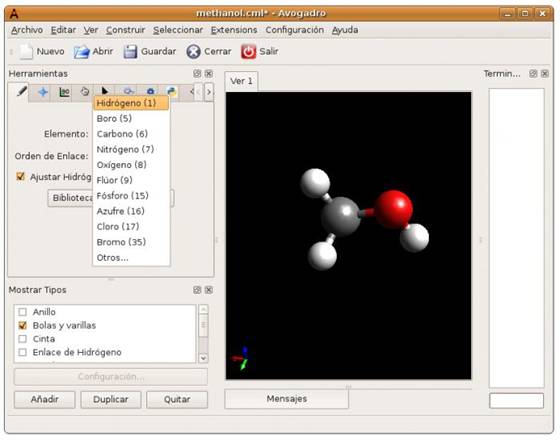
a) Sigan todos los pasos de la actividad 1 y dibujen las geometrías moleculares utilizando el programa Avogadro de sus equipos portátiles.
b) Con el programa Avogadro, dibujen los vectores de cada unión, y luego busquen en el menú la opción para calcular el vector resultante.
Actividad 3. Integradora
Realicen este experimento para determinar la polaridad de las siguientes sustancias: agua, etanol (alcohol medicinal) y hexano (también puede utilizarse nafta).
Nota: tengan mucho cuidado con las dos últimas sustancias, ya que son inflamables.
1. Tomen tres pies o soportes metálicos, coloquen una agarradera (para bureta sería mejor), y en ella, coloquen una bureta (en el caso de no tener bureta, pueden utilizar un tubo de vidrio al que se le agreguen, en un extremo, un pedacito de tubo de goma con una pinza para que el líquido no caiga).
2. Coloquen agua en la primera bureta, etanol en la segunda y hexano en la tercera.
3. Coloquen debajo de cada una de ellas un recipiente vacío (puede ser un vaso de precipitados o un frasco de mayonesa o dulce de boca ancha).
4. Froten una regla de plástico en la cabeza, en una piel o en un paño de lana. De esta manera la regla se cargará con electricidad estática y atraerá moléculas que tengan algún tipo de separación de cargas.
5. Abran el robinete o llave de la primera bureta, de tal forma de conseguir un chorro de líquido continuo, y acerquen la regla.
6. Observen si el líquido se desvía de la trayectoria original.
7. Tomen fotografías antes de acercar la regla y después de hacerlo.
8. Repitan la experiencia con los otros líquidos.
a) Armen una tabla con los resultados obtenidos. Pueden usar el programa Writer o Word de sus equipos portátiles. Incorporen las fotos obtenidas.
b) Con el programa Avogadro, dibujen la molécula de agua, la de etanol y la de hexano. Optimicen su geometría.
c) Determinen si las moléculas son o no polares siguiendo los pasos descriptos en la actividad 2. Correlacionen los resultados experimentales con los obtenidos aplicando el programa Avogadro.
d) Interpreten los resultados obtenidos sobre la base de la polaridad de las sustancias. Hagan una puesta en común con todos los grupos a través de los equipos en red o la plataforma Squeak.
Webgrafía recomendada
Uniones y geometría químicas (presentación PowerPoint)
Teorías
del
enlace covalente. Teoría de Lewis
Anexo