Neutralización ácido-base
 |
Autores: Silvia
Cerdeira, Helena Ceretti y Eduardo Reciulschi. Responsable
disciplinar: Silvia Blaustein. Área
disciplinar: Química. Temática:
Reacciones químicas. Nivel:
Secundario, ciclo básico. Secuencia didáctica
elaborada por Educ.ar. |
|---|
Propósitos generales
• Promover el uso de los equipos portátiles en el proceso de enseñanza y aprendizaje.• Promover el trabajo en red y colaborativo, la discusión y el intercambio entre pares, la realización en conjunto de la propuesta, la autonomía de los alumnos y el rol del docente como orientador y facilitador del trabajo.
• Estimular la búsqueda y selección crítica de información proveniente de diferentes soportes, la evaluación y validación, el procesamiento, la jerarquización, la crítica y la interpretación.
Introducción a las actividades
A finales de 1800, el científico sueco Svante Arrhenius propuso que el agua puede disolver muchos compuestos separándolos en sus iones individuales. Arrhenius sugirió que los ácidos son compuestos que contienen hidrógeno y pueden disolverse en el agua liberando iones de hidrógeno a la solución. Por ejemplo, el ácido clorhídrico (HCl) se disuelve en el agua de la siguiente manera:
HCl + H2O → H+(ac) + Cl-(ac)
Arrhenius también definió a las bases como sustancias que se disuelven en el agua liberandoiones oxidrilo (OH-) a la solución. Por ejemplo, una base típica de acuerdo con la definición de Arrhenius es el hidróxido de sodio (NaOH):
NaOH + H2O → Na+(ac) + OH-(ac)
Así, la teoría de Arrhenius explica en términos moleculares por qué todos los ácidos y todas las bases tienen características similares entre sí. La definición de Arrhenius también explica la observación de Boyle: los ácidos y las bases se neutralizan entre ellos. Esta idea –que una base puede debilitar un ácido y viceversa– es llamada neutralización.
Tal como se dijo, los ácidos liberan H+ en la solución y las bases liberan OH-. Si se mezclaran un ácido y una base, el ión H+ se combinaría con el ión OH- para formar la molécula H2O según la siguiente ecuación:
H+(ac) + OH-(ac) → H2O (l)
Aunque Arrhenius ayudó a explicar los fundamentos de la química sobre ácidos y bases, su teoría no podía explicar algunos hechos. Por ejemplo, la definición de Arrhenius no explica por qué algunas sustancias pueden actuar como ácidos o bases, a pesar deque no contengan H+ u OH-, como el bicarbonato de sodio (NaHCO3) y el amoníaco (NH3).
Objetivos de las actividades
Que los alumnos:
Actividad 1. Arrhenius y la neutralización
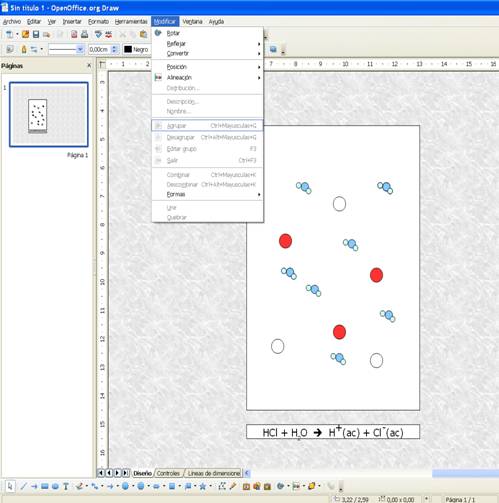
Representen la disolución de HCl e NaOH en agua y su neutralización empleando el programa Draw de sus equipos portátiles.
a) Primero deben decidir cómo se representará cada uno de los compuestos, por ejemplo:
HCl: con una esfera roja para los átomos de hidrógeno y una blanca para los átomos de cloro.NaOH: con una esfera amarilla para el ión sodio y una azul para el ión OH-.
H2O: tres esferas celestes (pueden pegarse entre sí seleccionando las tres esferas y yendo a la solapa Modificar > Agrupar).
b) En una primera caja, representen la disolución de ácido clorhídrico en agua y coloquen debajo la ecuación que la describe.
c) En una segunda caja, representen la disolución del hidróxido de sodio en agua y coloquen debajo la ecuación que la describe.
d) En una tercera caja, representen la mezcla de las dos disoluciones mostrando el proceso de neutralización.
Actividad 2. La neutralización y la salud
El poder neutralizar la acidez de algunas sustancias es de suma importancia para la salud humana. Por ejemplo, muchas personas sufren de acidez estomacal (los ácidos estomacales ayudan a la digestión pero a veces se encuentran en exceso).
Uno de los primeros «remedios» fue el ingerir sustancias básicas capaces de neutralizar el efecto de esos ácidos. Pero, cuidado, las bases también son corrosivas, por lo que tampoco pueden ingerirse en exceso.
Realicen una experiencia análoga a lo que podría suceder en el estómago si se tiene acidez y el médico receta ingerir antiácidos.
Materiales
• Papel de tornasol (o indicador de repollo preparado según la actividad de indicadores que figura en los enlaces de interés).• Vinagre (en realidad hay ácido clorhídrico en nuestro estómago, pero el vinagre es más fácil de conseguir y el efecto es similar).
• 1 gotero.
• 1antiácido comercial (a base de hidróxidos de aluminio y magnesio).
• 5 frascos pequeños de 50 o 100 ml.
• Una espátula pequeña.
• Una varilla.
Procedimiento
1. Muelan una o dos pastillas de antiácidos.
2. Rotulen los frascos del 1 al 5.
3. Coloquen en los cinco frascos 20 gotas de vinagre y 5 ml de agua.
4. En el frasco número 2, agreguen una punta de espátula de las pastillas de antiácido molidas. En el frasco 3, agreguen 2 puntas de espátula y así sucesivamente.
5. Agiten suavemente con una varilla el frasco 1 y toquen un trozo de papel tornasol con la varilla (el tornasol se pone rojo en presencia de ácidos, violeta oscuro con las bases y conserva su color si la solución es neutra).
6. Enjuaguen la varilla y repitan el procedimiento en el frasco 2, y así sucesivamente hasta el frasco 5.
7. Anoten el número de frasco en el cual se comience a observar que el papel tornasol indica la ausencia de acidez. Si no se observa la eliminación de la acidez en ninguno de los frascos 2 a 5, dupliquen el agregado de antiácido en todos los frascos y repitan la medición.
8. Continúen los agregados hasta detectar el frasco a partir del cual la acidez desaparece.
9. Verifiquen que en los frascos subsiguientes el papel de tornasol muestre reacción alcalina (aunque sea un poco). Si ponen demasiada cantidad de pastillas antiácidas, probablemente no alcance el agua para que se disuelvan y verán un residuo en el fondo del frasco.
a) Empleando el mismo tipo de esquema que realizaron en la actividad 1, representen las disoluciones de vinagre (puede simbolizarse como un ácido genérico HA) y el hidróxido de magnesio (o de aluminio).
b) Representen la reacción entre ambas soluciones en los casos en que todavía se observa acidez, cuando el tornasol indica neutralidad y cuando el tornasol muestra reacción alcalina (si pusieron un exceso de pastillas y ya no consiguen disolverlas, no hace falta representarlo).
Actividad 3. Otros usos de la neutralización
En medicina, la neutralización se puede utilizar para reducir el dolor de las picaduras de insectos o de efectos indeseables producidos por algunas plantas. Busquen qué plantas y qué tipo de picaduras de insectos u otros animales pueden aliviarse empleando reacciones de neutralización ácido-base. A modo de ejemplo, pueden consultar Neutralización de ácidos y bases.
Webgrafía recomendada
Neutralización con ácido-base (video con experimento de neutralización ácido-base).