Leyes de los gases
 |
Autores: Silvia Cerdeira, Helena Ceretti y
Eduardo Reciulschi. Responsable disciplinar:
Silvia Blaustein. Área disciplinar:
Química. Temática: Teoría cinética de los
gases. Ley de Boyle. Nivel: Secundario,
ciclo básico. Secuencia didáctica elaborada por Educ.ar.
|
|---|
Propósitos generales
• Promover el uso de los equipos portátiles en el proceso de enseñanza y aprendizaje.• Promover el trabajo en red y colaborativo, la discusión y el intercambio entre pares, la realización en conjunto de la propuesta, la autonomía de los alumnos y el rol del docente como orientador y facilitador del trabajo.
• Estimular la búsqueda y selección crítica de información proveniente de diferentes soportes, la evaluación y validación, el procesamiento, la jerarquización, la crítica y la interpretación.
Introducción a las actividades
Cerca de 570 años antes de Cristo, Anaxímedes pensaba que el aire era el material del que estaba constituido todo el universo. Propuso que el resto de los materiales se formaban cuando el aire se comprimía al irse acercando a la Tierra.
Recién en el año 1600, Jean-Baptiste van Helmont descubrió la importancia que tenía el aire en la formación de material biológico en los árboles. Este médico flamenco consideró a los gases como materia desordenada y sin forma (gas deriva de una palabra flamenca que significa caos).
Muchos científicos de la época comenzaron a estudiar las propiedades físicas de los gases. Se estableció que tenían masa (antes suponían que no) como el resto de los materiales y se inició el estudio de la «química neumática».
El físico y matemático italiano Evangelista Torricelli demostró que el aire ejercía presión sobre una columna de mercurio e inventó el barómetro, que medía la presión según la altura de dicha columna (Presión). De esta manera se establecieron empíricamente las leyes de los gases que relacionan las distintas variables que los caracterizan (temperatura, volumen, presión y cantidad de gas).
Objetivos de las actividades
Que los alumnos:
Actividad 1. Obtención de un gas en el laboratorio y medición de su volumen
Según la teoría cinética, la materia está constituida por partículas pequeñas en continuo movimiento. En el caso de los gases, dichas partículas se mueven al azar en todas direcciones y se encuentran muy separadas entre sí. Un gas puede caracterizarse por diferentes variables, como la temperatura a la que se encuentra, la presión que ejerce, el volumen que ocupa y la cantidad de gas que se esté analizando.
El objetivo de esta actividad es la obtención de un gas –en este caso, dióxido de carbono– y la medición posterior de su volumen*.
* Para los fines de los objetivos de esta secuencia didáctica no se tendrá en cuenta la estequiometría de la reacción como así tampoco la cantidad de ácido acético contenida en los vinagres comerciales.
Materiales
• Una botella plástica.• Globos.
• Una cucharita.
• Bicarbonato de sodio.
• Vinagre.
Procedimiento
1. Coloquen 100 ml de vinagre en una botella.
2. Coloquen una cucharadita de bicarbonato en un globo.
3. Sujeten el globo en la boca de la botella, con cuidado para que no se caiga el bicarbonato.
4. Levanten el globo y dejen que el bicarbonato entre en contacto con el vinagre.
5. Observen qué sucede con el globo a medida que va ocurriendo la reacción.
a) ¿Cómo podrían medir el volumen de gas obtenido? Ayuda: recuerden a Arquímedes, para eso visiten Fuerza de empuje y Principio de Arquímedes. Además, consideren que el dióxido de carbono es insoluble en agua.
b) Realicen otras experiencias agregando 2 y 3 cucharaditas de bicarbonato. Comparen el tamaño de los globos y anoten los volúmenes de las tres experiencias.
c) Junten toda la información en una tabla utilizando las herramientas del programa Writer de sus equipos portátiles. Incluyan las cantidades de reactivo utilizadas y el volumen de gas obtenido.
d) Sin realizar el experimento, ¿qué volumen de dióxido de carbono esperarían obtener en el laboratorio si agregaran 6 cucharaditas de bicarbonato de sodio?
e) ¿Qué relación existe entre la cantidad de gas generado en la reacción y el volumen que ocupa?
f) ¿Cómo podrían explicar el comportamiento del gas dentro del globo?
Actividad 2. Ley de Boyle
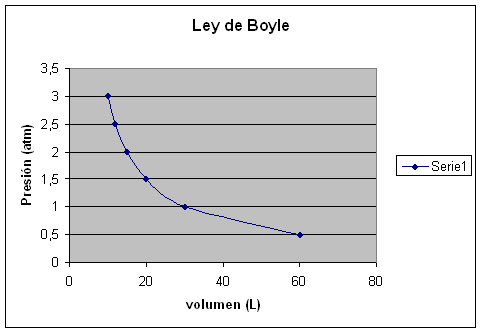
Robert Boyle (1627-1691) se propuso averiguar si había alguna relación entre el volumen que ocupa un gas dentro de un recipiente y la presión que soporta (manteniendo la temperatura constante). Colocó un gas en un cilindro con un émbolo (como el de las jeringas) y midió los diferentes volúmenes a distintas presiones (según la altura del émbolo). En la tabla se pueden observar datos como los que obtuvo Boyle.
Tabla 1. Datos de presión y volumen para una cierta cantidad de un gas
|
Presión (atm) |
Volumen (L) |
|---|---|
|
0,5 |
60 |
|
1,0 |
30 |
|
1,5 |
20 |
|
2,0 |
15 |
|
2,5 |
12 |
|
3,0 |
10 |
Parte A. Graficar variables
Un gráfico de datos experimentales bien elaborado es una organización efectiva de datos para poder observar tendencias, descubrir relaciones entre los datos o predecir información. Por eso es tan importante aprender a construir gráficos adecuadamente y a extraer información a partir de ellos.
Analizando los datos que se presentan en la tabla anterior, traten de encontrar una relación entre ambas variables, como lo hizo Boyle.
a) Utilicen las herramientas del programa Calc para construir un gráfico con los valores de volumen (eje x) y presión (eje y) (gráfico de dispersión x, y).
b) ¿Qué relación encuentran entre el volumen y la presión? ¿Son directa o inversamente proporcionales? ¿Pueden relacionarse a través de una ecuación matemática sencilla?
c) Comprueben sus resultados en los siguientes sitios:
Educaplus, Laboratorio, ley de Boyle
d) Para conocer cómo Boyle trabajó para deducir la ley, miren el video «Temperatura y la ley de los gases».
Parte B. Experimento
Se puede observar que al aumentar la presión (P) disminuye el volumen (V), es decir que son inversamente proporcionales. Si se multiplican los valores de P y V, se observa que siempre se obtiene el mismo número. Boyle enunció la ley que lleva su nombre de la siguiente manera:
A temperatura constante, el volumen ocupado por una determinada masa de gas es inversamente proporcional a la presión.
P V = constante
Para imitar el experimento de Boyle se pueden utilizan diferentes dispositivos, por ejemplo:
Materiales
• Papel milimetrado.• Jeringas descartables de 10 ml.
• Planchas de telgopor.
• Pesas.
• Alambre de cobre.
Armen el siguiente dispositivo:
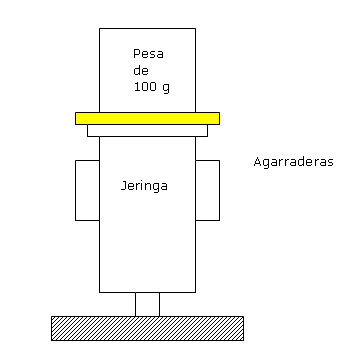 |
Procedimiento
1. Desplacen el émbolo de la jeringa hacia atrás y llénenla de aire hasta su capacidad máxima.
2. Agreguen lentamente pesas y anoten el nuevo volumen de gas (si resulta muy difícil apoyar las pesas sobre la plataforma, utilicen un alambre de cobre colocado sobre el émbolo y agreguen pesas a ambos extremos del mismo).
3. Repitan el procedimiento utilizando cinco pesos diferentes.
4. Calculen la inversa de los volúmenes (1/V).
a) Utilizando las herramientas del programa Writer de sus equipos portátiles, armen dos tablas: una de peso y volumen, y otra de peso y la inversa del volumen.
b) Hagan dos gráficos: uno que muestre presión (eje y) en función del volumen (eje x); y 2) presión en función de la inversa del volumen.
c) Sobre la base de los gráficos obtenidos, encuentren una relación entre presión y volumen. Relacionen con la Ley de Boyle.
Nota: el peso es una indicación de cuánta presión se ejerce sobre el émbolo. Para ser más exactos, se debería considerar que la presión es fuerza/área y, para hacer la conversión, se debe conocer la superficie del émbolo y luego calcular la presión (Fuerza/Área).
Para trabajar con las unidades más utilizadas, se debe hacer la conversión según las siguientes igualdades:
1 [kg/cm^2] = 98066,5 [Pa]
1 atm = 760 mmHg= 760 Torr, 1 atm = 101,325 Pa
Actividad 3. Actividad integradora
En las actividades 1 y 2, se observó que el volumen de un gas es directamente proporcional a la cantidad de gas e inversamente proporcional a la presión ejercida. Si se expresa la primera relación matemáticamente, se obtiene la siguiente ecuación:
![]()
En ella n es la cantidad de gas expresada en moles y k es una constante. Esta relación se conoce como Ley de Avogadro. Si se tiene una cierta cantidad de gas al principio (n1), se mide el volumen (V1) y luego se varía la cantidad de gas (n2), variará su volumen (V2). Entonces, otra forma de expresar la misma ley es:
![]()
Si se graficase el volumen de un gas en función de su cantidad (masa o número de moles), ¿qué tipo de gráfico se obtendría? ¿Por qué?
a) Utilizando las herramientas del programa Calc de sus equipos portátiles, completen una tabla como la siguiente y grafiquen los valores. ¿El gráfico obtenido coincide con las predicciones realizadas en la primera pregunta?
|
Volumen (L) |
Número de moles (n) |
|---|---|
|
2,5 |
0,75 |
|
|
0,9 |
|
4,5 |
|
|
|
1,5 |
|
10 |
|
b) Para calcular el número de moles de gas, visiten Cantidad de gas, en educaplus. Y para visualizar el experimento realizado por Avogadro: Ley de Avogadro, en educaplus.
Anexo
Gráfico de presión en función del volumen de un gas a una dada temperatura